潘伟春/牛付阁团队廖华斌JAFC发文:新型pH响应型缓释水凝胶微球补铁制剂构建
-
2025年9月,浙江工商大学潘伟春/牛付阁团队在美国化学学会知名期刊Journal of Agricultural and Food Chemistry(Q1,TOP,IF: 6.1)发表题为“pH-responsive sustained-release hydrogel microspheres for the protection, delivery and release of oral polysaccharide iron”的研究性论文。论文的第一作者为浙江工商大学22级硕士廖华斌,通讯作者为潘伟春教授和牛付阁副教授。

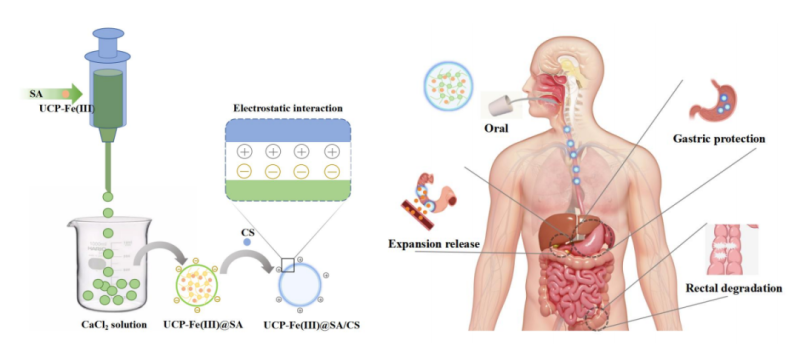
口服多糖铁复合物(UCP-Fe(III))在胃环境中容易发生降解,从而限制其应用并降低生物利用度。为解决这一问题,本研究开发了一种新型核壳结构海藻酸钠/壳聚糖水凝胶微球,用于实现UCP-Fe(III)的pH响应性保护与递送。实验结果表明,高浓度海藻酸钠(SA)溶液具有更高的粘度和储能模量。当SA浓度为1.0%时,微球对UCP-Fe(III)的包封率达到94.41%,载药量为13.38%,同时其硬度和咀嚼性也显著增强,这归因于高浓度SA促进了更密集的交联网络形成。微球在模拟胃液(SGF,pH 2.0)中溶胀率较低(467.33-588.50%),而在模拟肠液(SIF,pH 7.4)中迅速溶胀(800-962.17%),表现出显著的pH响应性释放行为,有效防止了药物的提前释放。本研究为开发具有pH响应缓释特性的口服铁补充剂提供了一种新策略。
研究亮点
-
核壳结构设计:采用SA与CS构建“核-壳”型水凝胶微球,利用二者之间的静电相互作用形成稳定的聚电解质复合物。
-
pH响应性机制:胃酸环境下:SA的羧基质子化(-COOH),壳聚糖氨基质子化(-NH3+),网络收缩,防止铁释放。肠液环境下(pH 7.4):羧基离子化(-COO-),产生静电排斥,微球溶胀,促进UCP-Fe(III)释放。
-
动力学机制研究:采用一级和二级动力学模型拟合溶胀数据,发现二级模型更符合实验数据,说明溶胀行为受多种机制共同控制。使用Zero-order、First-order、Higuchi、Korsmeyer-Peppas等模型拟合体外模拟消化数据,揭示了微球从Fickian扩散到侵蚀控制的释放机制转变。
研究结论
-
成功开发了一种具有核壳结构的海藻酸钠/壳聚糖水凝胶微球(PAC),用于包封和保护口服UCP-Fe(III),实现在胃肠道中的pH响应性缓释。
-
在模拟胃液(SGF, pH 2.0)中溶胀度低、释放率低,可有效防止UCP-Fe(III)在胃中降解;而在模拟肠液(SIF, pH 7.4)中迅速溶胀并持续释放,显著提高了铁的潜在生物利用度
-
SA浓度升高可增强微球的机械性能、包封率和缓释效果。
图文摘要
图文赏析
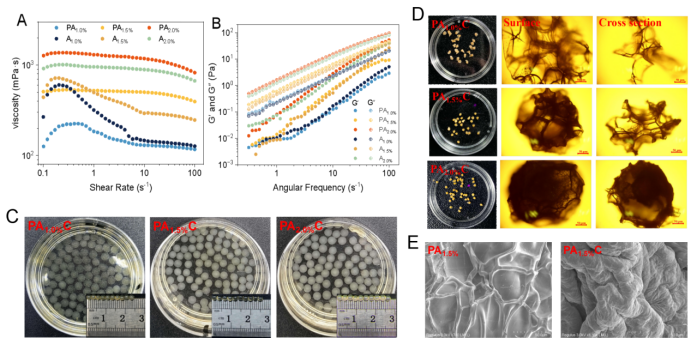
图 1.不同浓度下SA与UCP-Fe(III)混合后粘度 (A)、G′和G″变化(B)。新鲜制备的PAC水凝胶微球 (C)。冷冻干燥PAC水凝胶微球表面及横截面光学显微镜图像(比例尺= 50μm) (D)。PA1.5%和PA1.5%C冷冻干燥微球表面的扫描电镜图像(×500) (E)
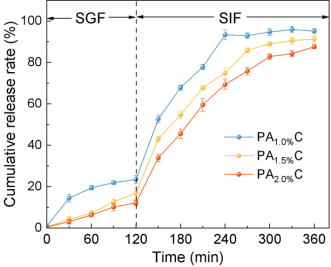
图2.PAC水凝胶微球的体外模拟消化释放行为
-
- 【上一条】 林全全副教授Food Hydrocolloids发文:玉米淀粉对基于组织化植物蛋白的肉类似物结构和蛋白消化性的影响
- 【下一条】 没有了
浙商大微信
浙商大新闻
浙商大微博
商大要闻
综合新闻
教学科研